Page 79 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 79
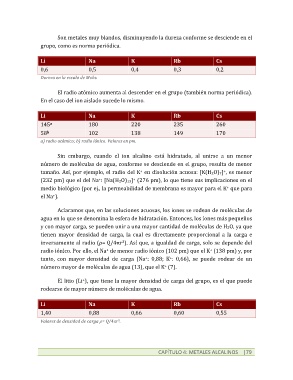
Son metales muy blandos, disminuyendo la dureza conforme se desciende en el
grupo, como es norma periódica.
Li Na K Rb Cs
0,6 0,5 0,4 0,3 0,2
Dureza en la escala de Mohs.
El radio atómico aumenta al descender en el grupo (también norma periódica).
En el caso del ion aislado sucede lo mismo.
Li Na K Rb Cs
145 180 220 235 260
a
58 102 138 149 170
b
a) radio atómico; b) radio iónico. Valores en pm.
Sin embargo, cuando el ion alcalino está hidratado, al unirse a un menor
número de moléculas de agua, conforme se desciende en el grupo, resulta de menor
tamaño. Así, por ejemplo, el radio del K en disolución acuosa: [K(H2O)7] , es menor
+
+
(232 pm) que el del Na : [Na(H2O)13] (276 pm), lo que tiene sus implicaciones en el
+
+
medio biológico (por ej., la permeabilidad de membrana es mayor para el K que para
+
el Na ).
+
Aclaramos que, en las soluciones acuosas, los iones se rodean de moléculas de
agua en lo que se denomina la esfera de hidratación. Entonces, los iones más pequeños
y con mayor carga, se pueden unir a una mayor cantidad de moléculas de H2O, ya que
tienen mayor densidad de carga, la cual es directamente proporcional a la carga e
inversamente al radio (ρ= Q/4πr ). Así que, a igualdad de carga, solo se depende del
3
radio iónico. Por ello, el Na de menor radio iónico (102 pm) que el K (138 pm) y, por
+
+
tanto, con mayor densidad de carga (Na : 0,88; K : 0,66), se puede rodear de un
+
+
número mayor de moléculas de agua (13), que el K (7).
+
El litio (Li ), que tiene la mayor densidad de carga del grupo, es el que puede
+
rodearse de mayor número de moléculas de agua.
Li Na K Rb Cs
1,40 0,88 0,66 0,60 0,55
Valores de densidad de carga ρ= Q/4pr .
3
CAPÍTULO 4: METALES ALCALINOS |79