Page 71 - Los elementos químicos: un manual extenso. A. Doadrio
P. 71
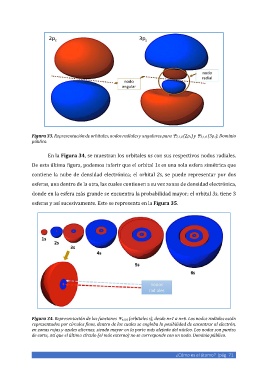
Figura 33. Representación de orbitales, nodos radiales y angulares para 2,1,0 (2pz) y 3,1,0 (3pz). Dominio
público.
En la Figura 34, se muestran los orbitales ns con sus respectivos nodos radiales.
De esta última figura, podemos inferir que el orbital 1s es una sola esfera simétrica que
contiene la nube de densidad electrónica; el orbital 2s, se puede representar por dos
esferas, una dentro de la otra, las cuales contienen a su vez zonas de densidad electrónica,
donde en la esfera más grande se encuentra la probabilidad mayor; el orbital 3s, tiene 3
esferas y así sucesivamente. Esto se representa en la Figura 35.
Figura 34. Representación de las funciones n,0,0 (orbitales s), desde n=1 a n=6. Los nodos radiales están
representados por círculos finos, dentro de los cuales se engloba la posibilidad de encontrar al electrón,
en zonas rojas y azules alternas, siendo mayor en la parte más alejada del núcleo. Los nodos son puntos
de corte, así que el último círculo (el más externo) no se corresponde con un nodo. Dominio público.
¿Cómo es el átomo? |pág. 71