Page 270 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 270
VARIACIÓN DE LAS PROPIEDADES PERIÓDICAS
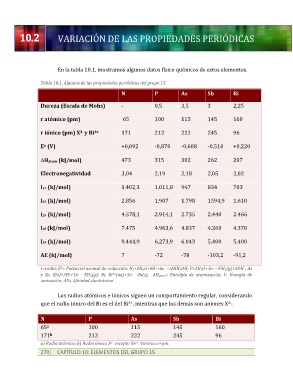
En la tabla 10.1, mostramos algunos datos físico químicos de estos elementos.
Tabla 10.1. Algunas de las propiedades periódicas del grupo 15.
N P As Sb Bi
Dureza (Escala de Mohs) - 0,5 3,5 3 2,25
r atómico (pm) 65 100 115 145 160
r iónico (pm) X y Bi 171 212 222 245 96
3+
3-
E (V) +0,092 -0,870 -0,608 -0,510 +0,220
o
DHatom (kJ/mol) 473 315 302 262 207
Electronegatividad 3,04 2,19 2,18 2,05 2,02
I1ª (kJ/mol) 1.402,3 1.011,8 947 834 703
I2ª (kJ/mol) 2.856 1.907 1.798 1594,9 1.610
I3ª (kJ/mol) 4.578,1 2.914,1 2.735 2.440 2.466
I4ª (kJ/mol) 7.475 4.963,6 4.837 4.260 4.370
I5ª (kJ/mol) 9.444,9 6.273,9 6.043 5.400 5.400
AE (kJ/mol) 7 -72 -78 -103,2 -91,2
r=radio; E = Potencial normal de reducción: N2+2H2O+6H +6e →2NH4OH; P+3H2O+3e-→PH3(g)+3OH ; As
+
–
0
−
y Sb: X(s)+3H +3e →XH3(g); Bi: Bi (aq)+3e →Bi(s); ΔHatom= Entalpía de atomización; I= Energía de
−
−
3+
+
ionización; AE= Afinidad electrónica.
Los radios atómicos e iónicos siguen un comportamiento regular, considerando
que el radio iónico del Bi es el del Bi , mientras que los demás son aniones X .
3+
3-
N P As Sb Bi
65 100 115 145 160
a
171 212 222 245 96
b
a) Radio atómico; b) Radio iónico X excepto Bi . Valores en pm.
3-
3+
270| CAPÍTULO 10: ELEMENTOS DEL GRUPO 15