Page 271 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 271
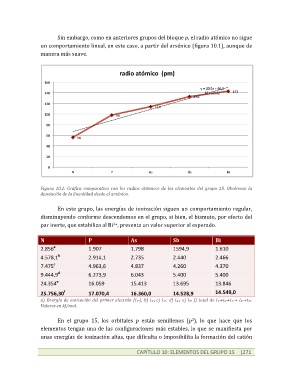
Sin embargo, como en anteriores grupos del bloque p, el radio atómico no sigue
un comportamiento lineal, en este caso, a partir del arsénico (figura 10.1), aunque de
manera más suave.
Figura 10.1. Gráfica comparativa con los radios atómicos de los elementos del grupo 15. Obsérvese la
desviación de la linealidad desde el arsénico.
En este grupo, las energías de ionización siguen un comportamiento regular,
disminuyendo conforme descendemos en el grupo, si bien, el bismuto, por efecto del
par inerte, que estabiliza al Bi , presenta un valor superior al esperado.
3+
N P As Sb Bi
a
2.856 1.907 1.798 1594,9 1.610
b
4.578,1 2.914,1 2.735 2.440 2.466
c
7.475 4.963,6 4.837 4.260 4.370
d
9.444,9 6.273,9 6.043 5.400 5.400
e
24.354 16.059 15.413 13.695 13.846
f
25.756,30 17.070,4 16.360,0 14.528,9 14.549,0
a) Energía de ionización del primer electrón (I1ª); b) I2ª; c) I3ª; d) I4ª; e) I5ª f) total de I1ª+I2ª+I3ª + I4ª +I5ª.
Valores en kJ/mol.
En el grupo 15, los orbitales p están semillenos (p ), lo que hace que los
3
elementos tengan una de las configuraciones más estables, lo que se manifiesta por
unas energías de ionización altas, que dificulta o imposibilita la formación del catión
CAPÍTULO 10: ELEMENTOS DEL GRUPO 15 |271