Page 283 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 283
ESTEREOQUÍMICA MOLECULAR
Excepto un número reducido de combinaciones iónicas que forman nitrógeno
(nitruros) y fósforo (fosfuros), las demás combinaciones binarias son moléculas de
enlace covalente. Son también frecuentes los cationes y aniones moleculares (por ej.
NH4 , BiO , N3 ) y cationes y aniones complejos (por ej. PCl6 , PBr4 ).
+
+
+
-
-
Hay que distinguir la estereoquímica molecular del nitrógeno con respecto al
resto de su grupo, ya que como en el caso del carbono, al no disponer de orbitales d,
no puede dar lugar a ciertos tipos de hibridaciones que sí son posibles en el resto del
grupo.
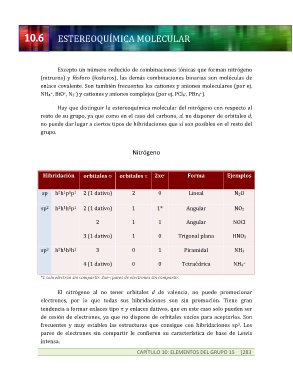
Nitrógeno
Hibridación orbitales s orbitales p 2xe Forma Ejemplos
-
sp h h p p 2 (1 dativo) 2 0 Lineal N2O
2 1 1 1
2
2 1 1 1
sp h h h p 2 (1 dativo) 1 1* Angular NO2
2 1 1 Angular NOCl
3 (1 dativo) 1 0 Trigonal plana HNO3
2 1 1 1
3
sp h h h h 3 0 1 Piramidal NH3
4 (1 dativo) 0 0 Tetraédrica NH4
+
*1 solo electrón sin compartir. 2xe-: pares de electrones sin compartir.
El nitrógeno al no tener orbitales d de valencia, no puede promocionar
electrones, por lo que todas sus hibridaciones son sin promoción. Tiene gran
tendencia a formar enlaces tipo p y enlaces dativos, que en este caso solo pueden ser
de cesión de electrones, ya que no dispone de orbitales vacíos para aceptarlos. Son
frecuentes y muy estables las estructuras que consigue con hibridaciones sp . Los
3
pares de electrones sin compartir le confieren su característica de base de Lewis
intensa.
CAPÍTULO 10: ELEMENTOS DEL GRUPO 15 |283