Page 344 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 344
VARIACIÓN DE LAS PROPIEDADES PERIÓDICAS
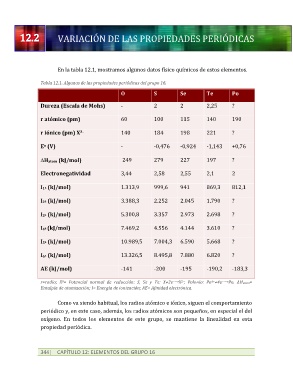
En la tabla 12.1, mostramos algunos datos físico químicos de estos elementos.
Tabla 12.1. Algunas de las propiedades periódicas del grupo 16.
O S Se Te Po
Dureza (Escala de Mohs) - 2 2 2,25 ?
r atómico (pm) 60 100 115 140 190
r iónico (pm) X 140 184 198 221 ?
2-
E (V) - -0,476 -0,924 -1,143 +0,76
o
DHatom (kJ/mol) 249 279 227 197 ?
Electronegatividad 3,44 2,58 2,55 2,1 2
I1ª (kJ/mol) 1.313,9 999,6 941 869,3 812,1
I2ª (kJ/mol) 3.388,3 2.252 2.045 1.790 ?
I3ª (kJ/mol) 5.300,8 3.357 2.973 2.698 ?
I4ª (kJ/mol) 7.469,2 4.556 4.144 3.610 ?
I5ª (kJ/mol) 10.989,5 7.004,3 6.590 5.668 ?
I6ª (kJ/mol) 13.326,5 8.495,8 7.880 6.820 ?
AE (kJ/mol) -141 -200 -195 -190,2 -183,3
r=radio; E = Potencial normal de reducción: S, Se y Te: X+2e →X ; Polonio: Po +4e →Po. ΔHatom=
0
2-
4+
−
-
Entalpía de atomización; I= Energía de ionización; AE= Afinidad electrónica.
Como va siendo habitual, los radios atómico e iónico, siguen el comportamiento
periódico y, en este caso, además, los radios atómicos son pequeños, en especial el del
oxígeno. En todos los elementos de este grupo, se mantiene la linealidad en esta
propiedad periódica.
344| CAPÍTULO 12: ELEMENTOS DEL GRUPO 16