Page 345 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 345
En los elementos del grupo 16, las energías de ionización siguen un
comportamiento regular, disminuyendo conforme descendemos en el grupo, sin que
se note el efecto del par inerte, que es débil.
O S Se Te
I1ª 1.313,9 999,6 941 869,3
I2ª 3.388,3 2.252 2.045 1.790
I3ª 5.300,8 3.357 2.973 2.698
I4ª 7.469,2 4.556 4.144 3.610
I5ª 10.989,5 7.004,3 6.590 5.668
I6ª 13.326,5 8.495,8 7.880 6.820
Suma I1ª a I6ª 41.788,20 26.664,70 24.573,00 21.455,30
Valores en kJ/mol.
Los valores de las energías de
ionización son muy altos. Por ello, no
tienen tendencia a formar el catión
elemental, de hecho, ninguno lo
produce, aunque selenio y teluro sí
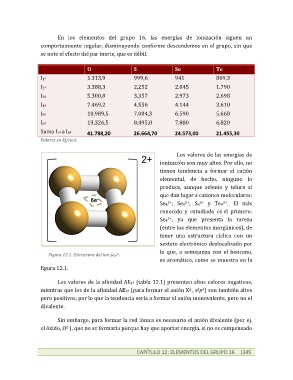
que dan lugar a cationes moleculares:
2+
2+
2+
Se4 ; Se8 ; S8 y Te4 2+ . El más
conocido y estudiado es el primero:
Se4 , ya que presenta la rareza
2+
(entre los elementos inorgánicos), de
tener una estructura cíclica con un
sexteto electrónico deslocalizado, por
lo que, a semejanza con el benceno,
Figura 12.1. Estructura del ion Se 4 .
2+
es aromático, como se muestra en la
figura 12.1.
Los valores de la afinidad AE1ª (tabla 12.1) presentan altos valores negativos,
mientras que los de la afinidad AE2ª (para formar el anión X , s p ) son también altos
2-
2 6
pero positivos, por lo que la tendencia sería a formar el anión monovalente, pero no el
divalente.
Sin embargo, para formar la red iónica es necesario el anión divalente (por ej.
el óxido, O ), que no se formaría porque hay que aportar energía, si no es compensado
2-
CAPÍTULO 12: ELEMENTOS DEL GRUPO 16 |345