Page 137 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 137
Los puntos de fusión no siguen una tendencia clara. El boro tiene un punto de
fusión muy elevado y sobresale de los demás elementos de su grupo. Los restantes,
tienen bajos puntos de fusión, despuntando el galio, por su bajísimo punto de fusión.
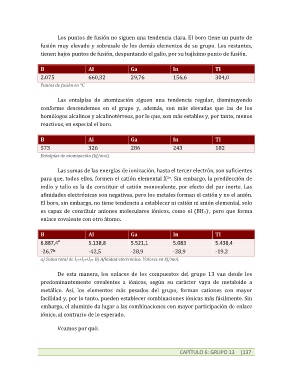
B Al Ga In Tl
2.075 660,32 29,76 156,6 304,0
Puntos de fusión en °C.
Las entalpías de atomización siguen una tendencia regular, disminuyendo
conforme descendemos en el grupo y, además, son más elevadas que las de los
homólogos alcalinos y alcalinotérreos, por lo que, son más estables y, por tanto, menos
reactivos, en especial el boro.
B Al Ga In Tl
573 326 286 243 182
Entalpías de atomización (kJ/mol).
Las sumas de las energías de ionización, hasta el tercer electrón, son suficientes
3+
para que, todos ellos, formen el catión elemental X . Sin embargo, la predilección de
indio y talio es la de constituir el catión monovalente, por efecto del par inerte. Las
afinidades electrónicas son negativas, pero los metales forman el catión y no el anión.
El boro, sin embargo, no tiene tendencia a establecer ni catión ni anión elemental, solo
es capaz de constituir aniones moleculares iónicos, como el (BH4) , pero que forma
-
enlace covalente con otro átomo.
B Al Ga In Tl
a
6.887,4 5.138,8 5.521,1 5.083 5.438,4
-26,7 -42,5 -28,9 -28,9 -19,2
b
a) Suma total de I1ª+I2ª+I3ª. B) Afinidad electrónica. Valores en kJ/mol.
De esta manera, los enlaces de los compuestos del grupo 13 van desde los
predominantemente covalentes a iónicos, según su carácter vaya de metaloide a
metálico. Así, los elementos más pesados del grupo, forman cationes con mayor
facilidad y, por lo tanto, pueden establecer combinaciones iónicas más fácilmente. Sin
embargo, el aluminio da lugar a las combinaciones con mayor participación de enlace
iónico, al contrario de lo esperado.
Veamos por qué:
CAPÍTULO 6: GRUPO 13 |137