Page 138 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 138
Las diferencias de electronegatividades entre los átomos que constituyen un
enlace son las que determinan si el enlace es más o menos covalente o iónico y si es
apolar o polar.
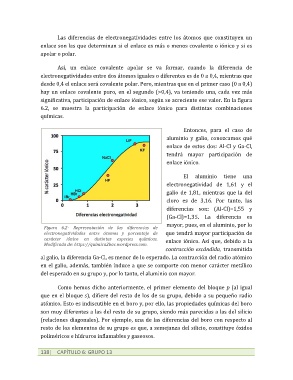
Así, un enlace covalente apolar se va formar, cuando la diferencia de
electronegatividades entre dos átomos iguales o diferentes es de 0 a 0,4, mientras que
desde 0,4 el enlace será covalente polar. Pero, mientras que en el primer caso (0 a 0,4)
hay un enlace covalente puro, en el segundo (>0,4), va teniendo una, cada vez más
significativa, participación de enlace iónico, según se acreciente ese valor. En la figura
6.2, se muestra la participación de enlace iónico para distintas combinaciones
químicas.
Entonces, para el caso de
aluminio y galio, conozcamos qué
enlace de estos dos: Al-Cl y Ga-Cl,
tendrá mayor participación de
enlace iónico.
El aluminio tiene una
electronegatividad de 1,61 y el
galio de 1,81, mientras que la del
cloro es de 3,16. Por tanto, las
diferencias son: (Al-Cl)=1,55 y
(Ga-Cl)=1,35. La diferencia es
mayor, pues, en el aluminio, por lo
Figura 6.2- Representación de las diferencias de
electronegatividades entre átomos y porcentaje de que tendrá mayor participación de
carácter iónico en distintas especies químicas. enlace iónico. Así que, debido a la
Modificada de: https://quimica2bac.wordpress.com.
contracción escándida, transmitida
al galio, la diferencia Ga-Cl, es menor de lo esperado. La contracción del radio atómico
en el galio, además, también induce a que se comporte con menor carácter metálico
del esperado en su grupo y, por lo tanto, el aluminio con mayor.
Como hemos dicho anteriormente, el primer elemento del bloque p (al igual
que en el bloque s), difiere del resto de los de su grupo, debido a su pequeño radio
atómico. Esto es indiscutible en el boro y, por ello, las propiedades químicas del boro
son muy diferentes a las del resto de su grupo, siendo más parecidas a las del silicio
(relaciones diagonales). Por ejemplo, una de las diferencias del boro con respecto al
resto de los elementos de su grupo es que, a semejanza del silicio, constituye óxidos
poliméricos e hidruros inflamables y gaseosos.
138| CAPÍTULO 6: GRUPO 13