Page 21 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 21
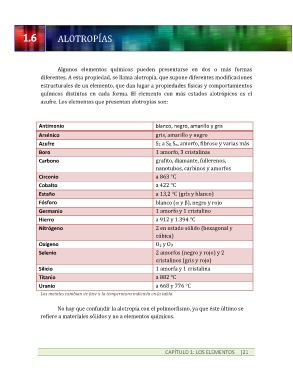
ALOTROPÍAS
Algunos elementos químicos pueden presentarse en dos o más formas
diferentes. A esta propiedad, se llama alotropía, que supone diferentes modificaciones
estructurales de un elemento, que dan lugar a propiedades físicas y comportamientos
químicos distintos en cada forma. El elemento con más estados alotrópicos es el
azufre. Los elementos que presentan alotropías son:
Antimonio blanco, negro, amarillo y gris
Arsénico gris, amarillo y negro
Azufre S2 a S8, Sn, amorfo, fibroso y varias más
Boro 1 amorfo, 3 cristalinas
Carbono grafito, diamante, fullerenos,
nanotubos, carbinos y amorfos
Circonio a 863 °C
Cobalto a 422 °C
Estaño a 13,2 °C (gris y blanco)
Fósforo blanco (a y b), negro y rojo
Germanio 1 amorfo y 1 cristalino
Hierro a 912 y 1.394 °C
Nitrógeno 2 en estado sólido (hexagonal y
cúbica)
Oxígeno O2 y O3
Selenio 2 amorfos (negro y rojo) y 2
cristalinos (gris y rojo)
Silicio 1 amorfa y 1 cristalina
Titanio a 882 °C
Uranio a 668 y 776 °C
Los metales cambian de fase a la temperatura indicada en la tabla.
No hay que confundir la alotropía con el polimorfismo, ya que éste último se
refiere a materiales sólidos y no a elementos químicos.
CAPÍTULO 1: LOS ELEMENTOS |21