Page 466 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 466
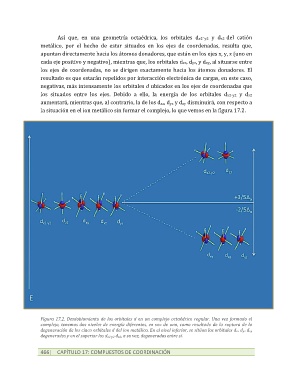
Así que, en una geometría octaédrica, los orbitales dx2-y2 y dz2 del catión
metálico, por el hecho de estar situados en los ejes de coordenadas, resulta que,
apuntan directamente hacia los átomos donadores, que están en los ejes x, y, z (uno en
cada eje positivo y negativo), mientras que, los orbitales dxz, dyz, y dxy, al situarse entre
los ejes de coordenadas, no se dirigen exactamente hacia los átomos donadores. El
resultado es que estarán repelidos por interacción electrónica de cargas, en este caso,
negativas, más intensamente los orbitales d ubicados en los ejes de coordenadas que
los situados entre los ejes. Debido a ello, la energía de los orbitales dx2-y2 y dz2
aumentará, mientras que, al contrario, la de los dxz, dyz y dxy disminuirá, con respecto a
la situación en el ion metálico sin formar el complejo, lo que vemos en la figura 17.2.
Figura 17.2. Desdoblamiento de los orbitales d en un complejo octaédrico regular. Una vez formado el
complejo, tenemos dos niveles de energía diferentes, en vez de uno, como resultado de la ruptura de la
degeneración de los cinco orbitales d del ion metálico. En el nivel inferior, se sitúan los orbitales dxz dyz dxy
degenerados y en el superior los dx2-y2 dz2, a su vez, degenerados entre sí.
466| CAPÍTULO 17: COMPUESTOS DE COORDINACIÓN