Page 82 - QUÍMICA INORGÁNICA DESCRIPTIVA-A. DOADRIO
P. 82
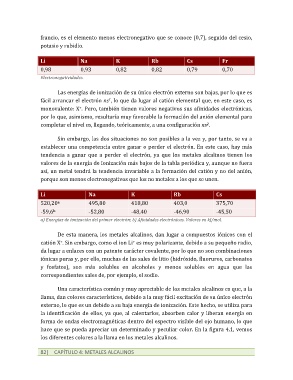
francio, es el elemento menos electronegativo que se conoce (0,7), seguido del cesio,
potasio y rubidio.
Li Na K Rb Cs Fr
0,98 0,93 0,82 0,82 0,79 0,70
Electronegatividades.
Las energías de ionización de su único electrón externo son bajas, por lo que es
fácil arrancar el electrón ns , lo que da lugar al catión elemental que, en este caso, es
1
monovalente: X . Pero, también tienen valores negativos sus afinidades electrónicas,
+
por lo que, asimismo, resultaría muy favorable la formación del anión elemental para
completar el nivel ns, llegando, teóricamente, a una configuración ns .
2
Sin embargo, las dos situaciones no son posibles a la vez y, por tanto, se va a
establecer una competencia entre ganar o perder el electrón. En este caso, hay más
tendencia a ganar que a perder el electrón, ya que los metales alcalinos tienen los
valores de la energía de ionización más bajos de la tabla periódica y, aunque no fuera
así, un metal tendrá la tendencia invariable a la formación del catión y no del anión,
porque son menos electronegativos que los no metales a los que se unen.
Li Na K Rb Cs
520,20 495,80 418,80 403,0 375,70
a
-59,6 -52,80 -48,40 -46,90 -45,50
b
a) Energías de ionización del primer electrón; b) Afinidades electrónicas. Valores en kJ/mol.
De esta manera, los metales alcalinos, dan lugar a compuestos iónicos con el
catión X . Sin embargo, como el ion Li es muy polarizante, debido a su pequeño radio,
+
+
da lugar a enlaces con un patente carácter covalente, por lo que no son combinaciones
iónicas puras y, por ello, muchas de las sales de litio (hidróxido, fluoruros, carbonatos
y fosfatos), son más solubles en alcoholes y menos solubles en agua que las
correspondientes sales de, por ejemplo, el sodio.
Una característica común y muy apreciable de los metales alcalinos es que, a la
llama, dan colores característicos, debido a la muy fácil excitación de su único electrón
externo, lo que es un debido a su baja energía de ionización. Este hecho, se utiliza para
la identificación de ellos, ya que, al calentarlos, absorben calor y liberan energía en
forma de ondas electromagnéticas dentro del espectro visible del ojo humano, lo que
hace que se pueda apreciar un determinado y peculiar color. En la figura 4.1, vemos
los diferentes colores a la llama en los metales alcalinos.
82| CAPÍTULO 4: METALES ALCALINOS